ゲノム編集で双子が誕生??
先週、中国でゲノム編集技術をつかってヒト受精卵の遺伝子改変をおこない、双子が生まれたというニュースがありました
▶ 毎日新聞 「ゲノム編集で双子」研究者、説得力ある説明せず
▶ BBC JAPAN 「世界初のゲノム編集赤ちゃん」の正当性主張 中国科学者
など。
ことの真偽は不明で、実際にこれが実施されたか否かについて、賀建奎(He Jiankui)氏からは説得力のある説明はなかったようです。しかし、倫理的・医学的な批判が起こっていて話題となっていますね
11月29日には中国の科学技術省がゲノム編集活動の中止を命令したようです。
▶ AFP 「中国・科技省、遺伝子編集活動の中止を命令」
ゲノム編集ってよく聞きますね
さて、ここのところ、といってもここ数年ですが、よく「ゲノム編集」という言葉を聞くと思います。遺伝子を書き換える技術なんでしょ、ということは何となくわかると思うのですが、実際に実験で毎日使っているので、今日は簡単にこの技術の解説を試みたいと思います。
とはいっても、専門的なことや、最先端のこと、例によって細かいことはいくらでもあって、研究成果も多いですが、また大雑把に王道を簡単に解説してみたいという試みです。
ゲノムとは
さて、まず言葉から入ります。初めに言葉ありき。「ゲノム」というのは「genome」なんですが、これは 遺伝子= gene + それらの総体 ome という意味合いですね。
生物はたくさん遺伝子を持っていますが、遺伝子全てをひっくるめてgenome と言っているんですね。
ゲノムというのは我々生物の設計図の総体という感じでとらえられているとおもいますが、おおすじはまちがいではありません。
実際には遺伝子情報は設計図がすべてではなくて、さまざまな修飾(これも一時話題だったエピジェネティクスとかいいます)が加わりますし、設計図を読み込む機構や環境によって実際に形成されるものは異なるので、設計情報だけがすべてではないのですが…。
細かいことは置いておいて原則で行きます。さらっと遺伝子について駆け足でみたあとに、ゲノム編集技術に行きたいと思います。
さて、遺伝子というのは核酸に情報が書き込まれています。核酸というのは DNA と RNA。真核生物という、細胞に核をもっているヒトなどは、DNAに遺伝子情報が書き込まれています

遺伝子の書き込まれ方としては、DNAにおいては4つの塩基が「文字」として機能しています。A,C,G,T の4つで、それぞれ アデニンadenine, シトシンcytosine, グアニンguanine, チミンthymine という塩基のことです。
RNAにおいては thymine のかわりに ウラシルuracil が使われています。A,C,G,U ですね。

完全に余談ですが、ウイルスの一部ではRNAが遺伝子を保持する役目を担っています。
遺伝子のコードのされ方
さて、遺伝子というのはA,C,G,T の文字の並びで記されています。実際にどのようにコードされているかというと、3文字が1セットになっていて、特定のアミノ酸と対応しています。

上の図は RNA で書かれていますが、最初の GCU というところが アラニンalanine というアミノ酸に対応しています。
この3文字のことをコドン(codon)と言い、真核生物においてはすべての組み合わせについてアミノ酸または機能が分かっています。

さて上の図は「コドン表」という暗号解読表のようなものを図にしています。
図の円の中心、真ん中から見ていきます。真下のちょっと左に向かってみると、中心に A のところがありますよね、その外側がTのところもあります。そしてさらにG。つまり、ATG。ここには Mと書かれていて、さらにSTART につながっています。
この読み方は、ATGという三文字は、M= メチオニン というアミノ酸に対応していて、さらに、この遺伝子の翻訳はここからスタートするよ、ということです。
さて、「翻訳」という言葉が軽くでてきました。
実は、遺伝子というのは設計図だと言いましたが何の設計図なのか。これが重要です。
遺伝子というのはタンパク質をコードする
なんの設計図かというと、遺伝子はタンパク質の設計図なのです。
タンパク質とは何か。それはアミノ酸が連なった鎖なのです。我々の体の構造や機能を担う多くの分子はタンパク質なんですね。
で、DNAに書き込まれている遺伝子情報からタンパク質を実際につくるまでの過程は大きく分けて二段階あるのです。
一段階目はおおもとの設計図であるDNA から一時的な情報伝達を担うRNA に情報を写し取る「転写」(transcript)、そして二段階目はそのRNA の情報をもとにアミノ酸をつないで鎖を作り、最終的にタンパク質をつくる「翻訳」(translation)というプロセスです。
さて。ここら辺の細かいことは分子生物学の基礎で非常に大事なのですが、今回は大雑把に、DNA→ RNA →タンパク質という形で設計図がタンパク質をつくることにつながっている、と理解していただければいいんじゃないかと思います。
深入りは全くしません
DNAには実際には遺伝子は連続して書き込まれているのではなく、スキップしていたりいろいろなのですが、そこもはしょって、A,C,G,T の文字列に情報が書き込まれているんだなと理解してもらえば今はよしとしましょう
ゲノム編集
では、さっそくゲノム編集に入っていきます。
ゲノム編集技術というのは、狙った遺伝子を改変する技術のことです。
遺伝子というのはDNAに書き込まれていたのでした。これを改変するということは、大きく分けて、遺伝子を切り取ったり、挿入したり、文字を書き換えたりということが考えられます。このいずれも行うことができる技術なんです。
さて、遺伝子を書き換えたりする、すなわちDNAを書き換えたりする、そういう方法は以前からありました。
それは相同組換えという方法です。これについては後で簡単にふれます。
相同組換えという方法はあるのですが、効率があまりよくないということもあり、実験において遺伝子を組み替えるのには時間と手間とコストがかかっていました。
しかし、2005年にZFN という技術が発見されて利用されるようになって以降、思い通りの遺伝子を改変する方法が発達し、効率的に遺伝子を編集できるようになりました。
これらの新しい技術のことをまとめて、ゲノム編集、と呼んでいるわけです。
ゲノム編集と呼ばれる技術はいずれも、基本的に、ヌクレアーゼ nuclease という酵素を用います。ふぁ?? なんだ、酵素?込み入らないように説明をします。
酵素について
酵素というのはラフに考えると機能をもったタンパク質のことです。
触媒機能、すなわち化学反応を促進する機能なんですが、まぁこの際、誤謬はありますが機能としてしまいます。
酵素の種類の名前は ase (アーゼ) で終わります。そして反応するものを先にくっつけて名前にします。
例えば、タンパク質(protein)を分解する酵素はprotease (プロテアーゼ)、脂質(lipid)を分解する構想はlipase(リパーゼ)ですね。
ヌクレアーゼ(nuclease)の、nucle… はなにかと言いますと、nucleic acid、すなわち核酸、すなわちDNAかRNAです。
そう、ヌクレアーゼというのは、DNAやRNAを分解する酵素のことなのです。
さて名前の説明をしてしまいましたが、ゲノム編集にはこのヌクレアーゼを用います。ヌクレアーゼはエンドヌクレアーゼやエキソヌクレアーゼなどと分類できますが、まずはよしとします。
こう考えます。ヌクレアーゼは、DNAを分解する。ただし、分解といっても粉々のばらばらにめちゃめちゃにするわけではなくて、「ある部分」において「DNAの鎖を切る」、そういう酵素だと考えてください。
DNAを切る
さて、DNAに戻ります。DNAは二本の鎖がらせんを形成した構造をもっています。ここで、ヌクレアーゼは鎖のうちの一本を「ある部位」で切ることができると考えてください。二本のうち一本に、ある一箇所で切れ目をいれることを「ニック」を入れると言ったりします。

DNAの鎖の一本をある個所で切ったとしても、相手側のもう一本の鎖が残っているので、ばらばらにはならず、図のようになりますね。

はぁ…DNAの鎖を切る…それがどうゲノム編集、すなわち塩基=文字を書き換えることにつながるの?。そう思いますよね。ここからです。
ニックをいれるということまでは分かりました。さて、もし、ニックが入った状況でもう一本のDNAの向かい側の同じ場所にニックが入ったらどうなるでしょうか。

はい、完全に鎖が切れてDNAは二つに分かれてしまいますね。

これを、二本鎖切断 = double strand break (DSB)と言います。
まぁ言葉は難しいですが、DSBといったらDNAの二本の鎖が切れた状態をつくることです。
さて、これが実際に起こってしまうと、情報を保存しているDNAが壊れますから、困ります。
こんなこと起こったら細胞は生きていけません。そこで、細胞はこういったDSB に対して修復をする装置を持っているんです。
DSBを修復する機構
その方法が大きく二つに分かれます。
1つは、「相同組換え」あれ、聞いたことありますかね。そう、ゲノム編集技術をつかわないで遺伝子を書き換えるときに実験でも使う方法なんです。
もう1つは「非相同末端結合」と言います。
あー言葉が難しくてもうぐちゃぐちゃですね。
しかし恐れることはありません。DSB = 二本鎖が切れる。そうすると細胞はそこを直そうとするわけです。その方法が「相同組換え」と「非相同末端結合」なわけです。
さて、「相同」って何?って話になりますよね。相同、ってお互いに同じ、って意味ですよね。何が、何と同じなのか。
実は、DNAの鎖が二本とも切れてしまった時には、切れた場所周辺と同じ配列をもつ別のDNAを鋳型にして切れてしまった部分を修復する、ということが起こりえます。
図で示します。細かい機構や機序は一切省きます。

さて、図の説明をします。
まずDSBが起こります。そうするとバラバラになってしまうんですが、それを防ぐためにいろいろな分子がやってきてこれを保護します。保護しているところに、切れた鎖の左右がある程度同じ配列をもっているDNAがやってきたとします。
そうすると、それを鋳型にして、切れた部分を直す分子がやってきて、直すことができるのです。この図では、真ん中に緑のところがあり、両端は違う配列(黒)ですが、赤と青の部分がおなじDNAがやってきました。
そうすると、赤と青のところを鋳型にして直すのですが、完成すると真ん中に緑のものが組み入れられています。この緑色のところがポイントになるんですね。この部分は1個の塩基でももっとたくさんの塩基でもいいのです。そしてまた0個でもいい。
そしてまた、赤と青で示した相同部分も完全に一致していなくてもいいのです👶ほとんどあっていればこの相同組換えは起こる。そうするとですね。この鋳型に、緑色のところでも、赤や青のところでも、変更したい塩基をいれておけば、もともとのDNAを置き換えられることになるんですね。
さて、次に、相同組換えとは違う方、非相同末端結合についても簡単に説明をしておきたいと思います。
こちらは、相同な鋳型のDNAを使わずにDSB(二本の鎖の切断でした)をつなぎ合わせる方法です。端っこと端っこがくっつくので末端結合といいます。

実はこの非相同末端結合が起こるときに、端っこだった部分がすこし失われて、DSBが起こる前より短くなることも起こるのです。
こうなると、遺伝子の一部の情報が失われます。これもゲノム編集に使われる一つの現象なのですが、細かくは省略します。遺伝子が失われることがある、と考えてしまってよいと思います。
さて、ここまでを少し振り返ります。
① 私たちの細胞では遺伝子はDNAに4文字の配列として書き込まれていました。3文字が1セットで1つのアミノ酸に対応していて、それがつながったタンパク質が作られるのでした。
②DNAを切るヌクレアーゼという酵素の一部は、DNAの一本の鎖を切る(ニックを入れる)ことができるのでした。二本の鎖を同じ場所で切る(DSB)と、DNAはバラバラになりかけますが、それを直す仕組み、を細胞は持っていました。
③その仕組みが「相同組換え」と「非相同末端組換え」であり、その仕組みを使ってDNAを修復すると、元とはちょっと異なった配列になることがある、ということが分かりました。
ゲノム編集の歴史
さて、先に進みます。
ここで、ゲノム編集の歴史の話をしながら、順番に技術の発展を見ていきます。最近よく聞く CRISPR/Cas9 (クリスパー・キャスナイン)というのが最も新しい技術である、というところまで行きます。
ゲノム編集の歴史としては、DNAを組換える技術が1973年に確立したことがはじめといえると思います。

1973年に、相同組換えを用いてのDNAの組換え技術ができました。ここでは詳細には触れませんが、効率とコストの問題があります。
もちろんこの技術はとても多用されました。
さて、大きな変化が起こったのが、1996年の ZFN という方法の発見と開発になります。
ZFN
ZFN というのは Zinc finger nuclease のことです。Zinc というのは金属の亜鉛のこと。Finger は指なのですが、Zinc finger というのは「亜鉛が結合するタンパク質のある構造」のグループで、
「DNAに結合する」性質をもっているのです。
ですから、Zinc finger というのは、DNAにくっつくタンパク質の部分のこと。
Nuclease はヌクレアーゼです。DNAを切るんでしたね。よって、ZFN は DNAにくっつく Zinc finger と ヌクレアーゼ、ということになります。
さて、ヌクレアーゼは「ある部位」でDNAを切るのでした。
その場所とはどこか。そこが問題です。
実際に細胞の中に存在しているヌクレアーゼは、DNAの特異的な配列、すなわち文字の並びを認識して切ったり、片っ端から切ったりといろいろです。
しかし、このヌクレアーゼの機能を、DNAを切るために使いたいと思った場合には、狙った場所のDNAを切ってもらう、ということができるようになる必要がありますね。
ここで、Zinc finger は何種類もあるのですが、あるものは「特定のDNAの塩基3文字を認識」する、という性質をもっています。
持たせることもできます。そうすると、こういうことができますね。

GGG を認識する ZF、GGTを認識するZF、GAC を認識するZFをつなげた ZFの鎖を作れば、GGGGGTGAC というDNAの配列を認識してくっつくものが作れる!
そして、この鎖の一番先っぽに、DNAを切るヌクレアーゼの、切る機能のある部分をくっつければ、特異的なDNAの配列(この場合GGGGGTGAC)の先っぽでDNAを切ることができるようになります。

そして、図にあるように、青と赤に対応する、ZFの2セットの鎖をつかってあげるんです。切りたいところの左側と、右側にそれぞれ特異的な配列を認識するZFの鎖をつくり、先っぽにヌクレアーゼ(図ではFok1)をくっつける。そうすると、狙ったところで DSB (二本の鎖を切る)ことができますね!
これがZFN です。
かなり画期的な方法で、この方法により、特異的な配列を決めれば狙った場所にDSBを引き起こすことができるようになりました。
TALEN
歴史に戻ります。次に出てきた技術が、TALEN というものです。
これは Transcription Activator-like Effector Nucleases の略です…難しい。
Transcription というのは「転写」のことで、DNAの情報をRNAにうつすこと、でした、そのあとの言葉の解釈は難しいのではしょりますが、DNAの情報をRNAに移す時にいろいろと作用するタンパク質があります。
そういったタンパク質の中に、あるDNAの1文字を認識することのできるタンパク質の部分が存在するんですね。
ZFと同じようなことなんですが、違う構造を持っています。
そういう、DNA を認識する部分をブロックのようにつなげれば、ZFNのように特異的な配列を認識できるようになる、そして、はじっこに同じようにヌクレアーゼをくっつければ、そこでDSBを起こせる、という発想、それがTALENです。

この二つの技術は画期的で、人工的にヌクレアーゼとDNA配列認識部分をくっつけているので、人工ヌクレアーゼといってよいものなのですね。
これらの技術をつかって、たくさん遺伝子改変が行われてきました。
そしてCRISPR/Cas9
しかし、真打として登場するのが CRISPR/Cas9 です。これはヌクレアーゼと他のユニットを組み合わせるというのとは、全く違う方法で、一気にゲノム編集の機運が高まったのです。
真打のCRISPR/Cas9 ですが、発見の経緯と、もともとは何であったのか、から入ります。
細菌は1個の細胞からなる生物です。え?細菌?
そう、実はCRISPR/Cas9 は細菌から見つかったのです。しかも、細菌のもっている免疫システムとして見つかったのです。
細菌に免疫?はぁ?細菌などから私たちを守るのが免疫なんじゃないの?
そう思われるかと思いますが、実は、細菌も狙われているんですね。
細菌が何に狙われているか。ウイルスです。細菌に感染する、たとえばファージというウイルスがいます。こういったウイルスは、細菌の中に自分のDNAやRNAを打ち込み、細菌の細胞を乗っ取って自分の子孫を作るんです。

ですから、細菌にウイルスが感染する、ということがおこるのです。
これに対して、細菌も抵抗しようという、そういう仕組みを持っています。その一つが、CRISPR/Cas9 の元になるシステムだったのです。
どういうことなのか順番に見ていきます。
Jinek et al. Nature Methods 10, 957–963 (2013)の図を借ります。
まず、ファージという細菌に感染するウイルスが細菌に表面にくっつき、自分のDNAを打ち込みます。

すると、細菌としてはこのDNAをつかってウイルスが増えては困るということもありますので、外来DNAとしてこれをばらばらに切断する分子をつかって壊します。この分子は Cas という分子複数個からなっています。

そしてばらばらに切ったウイルス由来のDNAの断片を、自分のDNAの中の、CRISPR と呼ばれる領域に組み込みます。
これが、「免疫記憶」にあたります。つまり、攻めてきたウイルスのDNA情報を切り取って、自分の中に組み込むことで覚えておくのです。

さて、免疫能力を発揮するのは、同じウイルスが二度目に攻め込んできたときになります。
ファージというウイルスがまたDNAを打ち込んできますが、細菌側としては、自分のDNAのCRISPR という部分に組み込んでおいた ファージ由来のDNA断片をRNAとして転写します。

また、同時に、「Cas9」というタンパク質と、「トラッカーRNA」という足場になるようなRNAからなる部品も作ります。

作られた ①「Cas9」 は、②「CRISPR 領域から転写したRNA 」と③「トラッカーRNA」とをまとめて複合体を作ります。ここが肝です。

この複合体は、④「ウイルスが打ち込んできたDNA」のうち、「CRISPR領域に組み込んで記憶しておいたのと同じ配列を持つ部分」を認識して、その部分にくっつきます。つまり、特異的な配列を認識してくっつくわけです。
そして、特異的な配列の根本の部分で、ウイルスが打ち込んできたDNAにDSB、つまり二本鎖の切断をひき起こします。
こうして、ウイルスが打ち込んできたDNAを分解するのです。

さて、この仕組み、ざっくりまとめてしまうと、「特異的なDNAの配列を認識するRNAと、Cas9というヌクレアーゼを使って、狙った部分でDNAにDSBをおこす」というシステムですね。
これは、考えてみれば、ゲノム編集に応用できそうではありませんか!
だって、「特異的な配列」を狙って、「DSBを起こす」ことができるのですから。
そこで、これを応用したのが、CRISPR/Cas9 システムなのです。
仕組みは細菌のもっているのものを応用して少し変更したものです。
CRISPR/Cas9 をツールとして使う
細菌のCRISPR領域に組み込まれた配列はRNAとして転写されますが、このRNAは「特異的な配列を認識する」、という役割をもつものでした。このRNAをガイドするRNAという意味で 「gRNA」と呼ぶことにします。
さて、gRNAは、「トラッカーRNA」という足場となるパーツとCas9とくっついて複合体をつくるのでした。しかし、ここで人工的にすこし細工をします。
gRNA とトラッカーRNAを人工的につなげた RNAを作ってしまえばいいのではないか、そういいう発想です。
そうすると、この 「gRNA+トラッカーRNA」と「Cas9」があれば、gRNAに対応した特異的配列のDNAを認識して、DSBを引き起こすことができます。
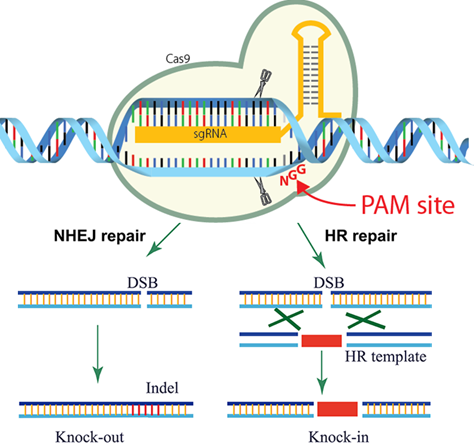
これが、CRISPR/Cas9 システムをツールとしてつかうことになるのです!
実際には図にあるように、PAMという配列が必要だったり、Cas9もいろいろな種類があったりするのですが、そこは今回は省略します。
簡単にまとめると
さて、まず CRISPR/Cas9 について振り返ります。
このシステムは、細菌がウイルスから自分を守るシステムでした。ウイルス由来のDNAの特異的な配列にDSBを引き起こすシステムで、認識にはRNAを使いました。そして、RNAは gRNAとトラッカーRNAからなるのでしたが、これは人工的にくっつけることができたのでした。
というわけで、真打のCRISPR/Cas9 システムまで見ました。
歴史の振り返りとしては、ヌクレアーゼと認識タンパク質で作られた ZFN → TALENと、きて、ヌクレアーゼであるCas9 と認識するRNAで作られた CRISPR/Cas9 システムが出てきた、というわけです。
さて、DSBを引き起こしたあとの組換え方法やノックアウトと呼ばれる遺伝子をつぶす方法の詳細は、…はぶいちゃいます!とにかく、このテクニックを使うと、遺伝子を書き換えられるんだ、ということがわかっていただければまずは満足です。
時事問題に戻ります
ここからは、今回中国で騒動となったCCR5 という分子の背景と、技術的になにが問題なのかな、ということを呟きたいと思います。
倫理的なことは今日は呟きません。定見ももたないので…。
さて、今回の報道では、中国で行われたと主張されている内容は、ヒトの受精卵にゲノム編集を行って、CCR5という分子を叩き潰した、そういうヒトを作ったよ、という話なんです。
CCR5は細胞の表面にでているタンパク質です。
ケモカイン受容体という仲間で、情報をキャッチするのが本来の仕事です。
しかし、なにが大事かというと、このCCR5は エイズを引き起こすウイルスである HIV が、細胞に感染するときに重要だということです。
下の図に示すように、HIV(HIV-1)は ウイルスの表面にあるgp120 という分子が、細胞の表面にあるCCR5とくっつくことで、細胞にくっつきます。
そして、その後、いくつもの分子が働いて、細胞の中に侵入していくのです。

とすると、このCCR5がなければどうなるか。
HIVは細胞に入れませんから、感染しないんですね。というわけで、これは細胞レベルの実験ではよく知られていることでした。
そして、2010年にはこんな論文が出ています。Holt N et al. Nat Biotechnol. 2010 Aug;28(8):839-47.

この論文では、ヒト化マウスのCCR5をゲノム編集で無くしたうえで、HIVの感染実験をしています…はぁ??
かみ砕きます。まず、HIV というのはヒトには感染しますが、マウスに感染しません。なので、普通のマウスでは動物実験ができないのです。HIVが感染しなければなにも起きないので。
そこで、ヒト化マウスというものを作ります。ヒト化、というのはどういう意味かというと、マウスの、血液だけをヒトのものに入れ替えたマウス、というような意味です。そういうことができるんです。
どうやって作るかというと、免疫が不全のマウスというのがいて、そのマウスの血液細胞をまずすべて殺してしまいます。そのあとにヒトの血液細胞のもとになる造血幹細胞という細胞をこのマウスに入れるんですね。そうすると、それが分化して血液細胞になるので、マウスの血液をヒト由来のものに置き換えることができるのです。
これが、ヒト化マウス。
ヒト化マウスでは、血液がヒト由来になっています。ここで、エイズのウイルスであるHIVは血液細胞の一種であるT細胞などに感染しますのでこの、ヒト化マウスにはHIVウイルスが感染するのです。
よって、ヒト化マウスはHIVの研究に使えるモデルマウスということなのですね。
さて、論文に戻ります。この論文ではなにをしたか、それが大事です。もし、ヒト化マウスの中にあるヒト由来の血液細胞にCCR5がなかったらどうなるでしょうか。そういう話です。
CCR5はHIVが感染するのに必要なのでした。だからCCR5がなければ、このマウスはHIVに感染しない、そういうことになる、ということが予想されますよね。
では、どうやってCCR5を消せばいいのか。そこでゲノム編集技術です。
ヒト化マウスは、ヒトの造血幹細胞を入れて作るのでした。であれば、ヒトの造血幹細胞にゲノム編集をして、CCR5をなくしたあとにマウスにいれたらどうだろう。それをやったのがこの論文です。
使った方法は ZEN。ついてきてくださった皆さんならお気づきの、最初に作られたゲノム編集技術ですね。これをつかってヒト造血幹細胞のCCR5を叩き潰しました。
そして、その造血幹細胞をマウスにうって、ヒト化マウスの血液細胞からCCR5が消えたことを確かめました。
そして、HIVを打ったんですね。そうすると、ZENを使っていないマウス=CCR5があるマウスでは脾臓にいる細胞のうちCD4陽性細胞という細胞が消えてしまいましたが、CCR5がないゲノム編集済のマウスでは消えませんでした。
CD4陽性細胞というのはHIVのターゲットとなるT細胞なんです。つまり、CCR5のあるマウスではその細胞がHIVに殺されてしまいましたが、CCR5をなくすと殺されなかったんですね。
ということで、この論文ではCCR5をなくせば、HIVへの感受性がなくなる、すなわち感染しない能力が得られる、ということが示唆されたわけです。
このCCR5に関しては、TALENを使って叩き潰し、HIV感受性が減るということを示した論文もあります。
TALEN-Mediated Knockout of CCR5 Confers Protection Against Infection of Human Immunodeficiency Virus. Shi B et al. J Acquir Immune Defic Syndr. 2017 Feb 1;74(2):229-241.など
こういったことから、HIVに対する治療的なアプローチとしてのゲノム編集は注目されてきていたのです。
The therapeutic application of CRISPR/Cas9 technologies for HIV. Saayman S et al. Expert Opin Biol Ther. 2015 Jun;15(6):819-30. などでそのあたりのことはまとめられていました。
今回のニュース
今回のニュースにもどります。
つまり、CCR5をつぶす、これがヒトでも同じことができ、ゲノム編集でCCR5をつぶしてしまえば、HIVに感染しないヒトができるのでは…そういうことだったんです。実際、CCR5が少し違う(CCR5-Δ32という変異)ヒトというのはいて、マクロファージ指向性という特徴のあるHIVにかかりにくい/かからないことも知られています。
そこに発想を得ての、今回の発表だったんですね。ことの真偽はわかりませんけれども。
さて、では、倫理ではなく、技術的にどんな問題があるのか、一点だけ触れたいと思います。
技術的な問題は
いままでのふれてきたようにゲノム編集技術である「CRISPR/Cas9」法は、「特異的な」つまり、「狙った遺伝子」を「正確に」編集できる、のではないかと考えられてきました。
しかし、実はこれには落とし穴があったのです。
狙ったところ以外の遺伝子にも影響を与えてしまう効果がある…。そういったことがわかってきました。これを標的の外への影響、という意味で「Off-Traget effect」 と呼んでいます。
言い換えるとこれは、gRNAで認識するところ以外の遺伝子も切ってしまったりする効果がCRISPR/Cas9にはある、という問題です。
そしてさらに、今年の7月には Nature Biotechnology に、標的とした遺伝子周囲のDNAにたくさんの欠失や再構成を引き起こすということが報告されたのです。
(nature による紹介記事: https://www.nature.com/articles/d41586-018-05736-3)
元の論文は
Repair of double-strand breaks induced by CRISPR–Cas9 leads to large deletions and complex rearrangement. Michael Kosicki, Kärt Tomberg & Allan Bradley
Nature Biotechnology volume 36, pages 765–771 (2018)
https://www.nature.com/articles/nbt.4192 です。
この論文の前にも実は、同じような解析はありました。
CRISPR/Cas9 targeting events cause complex deletions and insertions at 17 sites in the mouse genome. Shin HY et al. Nat Commun. 2017 May 31;8:15464. doi: 10.1038/ncomms15464. https://www.nature.com/articles/ncomms15464
さて、Nat biotechnologyの論文では、狙った遺伝子ではない部分にたくさんの異常がおこることから、pathogenic すなわち不具合を引き起こす可能性がある、と結論付けています。
つまり、現時点でのゲノム編集技術は、狙ったところだけを改変する完全な技術ではなさそう、ということですね。これは問題です。
この技術はそういう意味でまだまだ検討していかねばなりませんし、こういった問題を解決しなくてはなりません。
治療応用や、ましてやヒト受精卵をいじるという段階にはまだ達していないように思います。
そのほかにも実は、ヒトの遺伝子はそれぞれ同じものが最低2個のっているのですが、その片一方しか編集できなかったり、すべての細胞を編集はできなかったりという問題もあるのですが、ここらへんは端折ります。
(興味のある方は nature ダイジェスト 2015年にすでにこんな記事があります:ヒトの生殖系列のゲノムを編集すべきでない )
さて、というわけで、今回は長くなりました(実はここまでで11000文字を超えてしまいました)がゲノム編集を時事問題にからめて触れてみました。
かなり端折っていますし、簡単にしているので語弊もあるかと思います。
最後にゲノム編集に関係する資料を置いておきます!
▶ 英語版ですがゲノム編集について詳しいフリーブックが addgene で手に入ります (https://info.addgene.org/download-addgenes-ebook-crispr-101-2nd-edition)
▶ 日本語の資料としてはコスモバイオの YouTube がわかりやすいですね。
気が向きましたらクリックをお願いします!↓















